- Tipos de enlaces químicos (definición, tipos, características generales).
- El enlace metálico (en profundidad).
- Características de los materiales metálicos.
- Metalografía:
Estructura microscópica de los metales.5.Materiales metálicos:
Clasificación por densidad e importancia industrial.
El Acero.
El aluminio.
Lo primero daré a conocer que es un enlace químico y luego ya explicaré la variedad de enlaces químicos que hay.
1.Tipos de enlaces químicos (definición, tipos, características generales):
Un enlace químico es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos. Los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas.
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
Una vez conocido lo que es un enlace químico, explicaré los distintos tipos de enlaces químicos.
Enlace covalente: un enlace covalente es la unión entre átomos en donde se da un compartimiento de electrones, los átomos que forman este tipo de enlace son de carácter no metálico. Las moléculas que se forman con átomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula.

Se presenta entre los elementos con poca diferencia de electronegatividad (< 1.7), es decir cercanos en la tabla periódica de los elementos químicos o bien, entre el mismo elemento para formar moléculas diatómicas.
Dentro de los enlaces covalentes, hay enlaces covalentes polares y no polares. Los enlaces covalentes polares se forman entre átomos de diferentes elementos, y la diferencia de electronegatividad debe ser mayor que 0,4. En este enlace, los electrones son atraídos fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo).
Los enlaces covalentes no polares se forman entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy pequeña (menor que 0,8). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme.
Enlace iónico o electrovalente: es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan; sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la diferencia (delta) de electronegatividades sea más que 1,7.

Enlace iónico de fluoruro de sodio
Sus enlaces son muy fuertes (depende fuertemente de la naturaleza de los iones).
Son sólidos a temperatura ambiente y poseen una estructura cristalina en el sistema cúbico. (Hay compuestos iónicos que son líquidos a temperatura ambiente denominados "líquidos iónicos" o "Sales Derretidas", con un campo de aplicación gigantesco.)
Altos puntos de fusión (entre 300 °C y 1000 °C) y ebullición (Si el enlace tiene un carácter covalente alto, puede ser que estos valores disminuyen abruptamente)
Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
Son solubles en agua y otras disoluciones acuosas debido al dipolo eléctrico que presentan las moléculas de agua; capaces de solvatar a los iones, compensando así la energía de red cristalina. (No todos los compuestos iónicos se pueden solubilizar fácilmente con agua, ya sea por la poca energía de solvatación de los iones o por el carácter covalente del compuesto iónico).
Una vez en disolución acuosa son excelentes conductores de electricidad, ya que entonces los iones quedan libres. (Hay una gran variedad de compuestos iónicos que son poco o muy poco solubles en disolución acuosa, también debido al carácter covalente del compuesto y que no permite que el agua separe fácilmente la red cristalina, resultando así en una muy pobre conductividad en disolución).
En estado sólido no conducen la electricidad, ya que los iones ocupan posiciones muy fijas en la red. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y, por ello, este funciona.
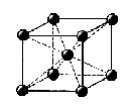
Enlace metálico: es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
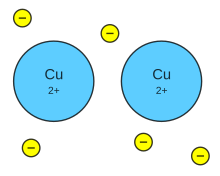
Enlace metálico en el cobre
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
No voy a entrar más en explicar el enlace metálico ya que me tengo que centrar más en el en el siguiente punto y los enlaces que he explicado son los más usuales ya que hay que tener en cuenta que existen más enlaces.
2.El enlace metálico (en profundidad).
Antes de nada, voy a dar la definición de metal: se denomina a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos a temperatura ambiente (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución.
Antes de nada, voy a dar la definición de metal: se denomina a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos a temperatura ambiente (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución.
Plancha de metal
Continuando el tema del enlace metálico y partiendo que el tema trata de la introducción a los materiales metálicos, me voy a centrar más en lo que es un enlace metálico y voy a analizarlo más. Anteriormente ya he dicho lo que es un enlace metálico pero voy a extenderme un poco más.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica.
Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal.
El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
Dentro de el enlace metálico, nos encontramos con la teoría del gas electrónico que es: mediante la teoría del gas electrónico podemos explicar por qué los metales son tan buenos conductores del calor y la electricidad, pero es necesario comprender la naturaleza del enlace entre sus átomos.
Un primer intento para explicar el enlace metálico consistió en considerar un modelo en el cual los electrones de valencia de cada metal se podían mover libremente en la red cristalina. De esta forma, el retículo metálico se considera constituido por un conjunto de iones positivos (los núcleos rodeados por su capa de electrones) y electrones (los de valencia), en lugar de estar formados por átomos neutros.
En definitiva, un elemento metálico se considera que está constituido por cationes metálicos distribuidos regularmente e inmersos en un «gas electrónico» de valencia deslocalizados, actuando como un aglutinante electrostático que mantiene unidos a los cationes metálicos.
El modelo del «gas electrónico» permite una explicación cualitativa sencilla de la conductividad eléctrica y térmica de los metales. Dado que los electrones son móviles, se pueden trasladar desde el electrodo negativo al positivo cuando el metal se somete al efecto de una diferencia de potencial eléctrico. Los electrones móviles también pueden conducir el calor transportando la energía cinética de una parte a otra del cristal.
En este apartado también engloba a la teoría de bandas: la teoría se basa en el hecho de que en una molécula los orbitales de un átomo se solapan produciendo un número discreto de orbitales moleculares.
Dentro de la teoría de bandas, hay dos bandas de energía: banda de valencia y banda de conducción.
La banda de valencia: está ocupada por los electrones de valencia de los átomos, es decir, aquellos electrones que se encuentran en la última capa o nivel energético de los átomos. Los electrones de valencia son los que forman los enlaces entre los átomos, pero no intervienen en la conducción eléctrica.
La banda de conducción: está ocupada por los electrones libres, es decir, aquellos que se han desligado de sus átomos y pueden moverse fácilmente. Estos electrones son los responsables de conducir la corriente eléctrica.
Estructura metálica: un metal está ordenado en celdas cristalinas como por ejemplo una celda cúbica simple. Cuando el metal fundido se solidifica, en varios puntos se comienza a reagrupar las moléculas y forman un núcleo que crece en todas las direcciones.
La agrupación de celdas que se solidifican, crecen tridimensionalmente hasta que se encuentran unas con otras y se detiene el crecimiento. Esto produce zonas en las cuales la red cristalina está ordenada (granos) y zonas que se denominan límites de grano o fronteras de grano en donde no existe orden alguno.
Ya explicado algunos enlaces y explicado más en extensión el enlace metálico, ahora voy a dar a conocer las características de los materiales metálicos.
Los metales tienen ciertas características físicas a excepción del mercurio son sólidos a condiciones ambientales normales, suelen ser opacos y brillantes, tener alta densidad, ser dúctiles y maleables, tener un punto de fusión alto, ser duros, y ser buenos conductores del calor y electricidad. Estas propiedades se deben al hecho de que los electrones exteriores están ligados sólo ligeramente a los átomos, formando una especie de mar (también conocido como mar de Drude), que se conoce como enlace metálico.
4.Metalografía.
La metalografía es la ciencia que estudia las características micro estructurales o constitutivas de un metal o aleación relacionándolas con las propiedades físicas, químicas y mecánicas.
Mucha es la información que puede suministrar un examen metalográfico, para ello es necesario obtener muestras que sean representativas y que no presenten alteraciones debidas a la extracción y/o preparación metalográfica.
Estructura microscópica de los metales:Una capacidad de los metales es que pueden cristalizarse. A continuación voy a explicar el tema de las diferentes estructuras con las que los metales se cristalizan.
Existen 14 estructuras cristalinas diferentes, yo voy a explicar las 3 más importantes:
- BCC (estructura cúbica centrada en el cuerpo).
Cada átomo de la estructura, está rodeado por ocho átomos adyacentes y los átomos de los vértices están en contacto según las diagonales del cubo.
- FCC (estructura cúbica centrada en las caras).
Está constituida por un átomo en cada vértice y un átomo en cada cara del cubo. Los metales que cristalizan en esta estructura son: hierro gama, cobre, plata, platino, oro, plomo y níquel. Cada átomo está rodeado por doce átomos adyacentes y los átomos de las caras están en contacto.
- HCP (estructura hexagonal compacta).
Esta estructura está determinada por un átomo en cada uno de los vértices de un prisma hexagonal, un átomo en las bases del prisma y tres átomos dentro de la celda unitaria. Cada átomo está rodeado por doce átomos y estos están en contacto según los lados de los hexágonos bases del prisma hexagonal. Los metales que cristalizan en esta forma de estructura son: titanio, magnesio, cinc, berilio, cobalto, circonio y cadmio.
Y esta imagen representa a los tres estructuras.
Grano.
El tamaño de grano tiene un notable efecto en las propiedades mecánicas del metal. Los efectos del crecimiento de grano provocados por el tratamiento térmico son fácilmente predecibles. La temperatura, los elementos aleantes y el tiempo de impregnación térmica afectan el tamaño del grano.
En metales, por lo general, es preferible un tamaño de grano pequeño que uno grande. Los metales de grano pequeño tienen mayor resistencia a la tracción, mayor dureza y se distorsionan menos durante el temple, así como también son menos susceptibles al agrietamiento. El grano fino es mejor para herramientas y dados. Sin embargo, en los aceros el grano grueso incrementa la dureza, la cual es deseable a menudo para la carburización y también para el acero que se somete a largos procesos de trabajo en frío.
Cristal.
Para poder cambiar la estructura de un metal debemos de hacer una cristalización, para esto debemos de calentar el metal hasta llegar el punto de superar su temperatura de fusión y con esto conseguimos romper las uniones de los átomos con lo que posteriormente al enfriarse y unirse obtenemos la cristalización que nosotros deseemos.
La primera deducción que sacamos es que este proceso es imposible pero en 1912, Max Von Laue descubrió que mediante Rayos X podíamos colocar los átomos allá donde queramos.
La primera deducción que sacamos es que este proceso es imposible pero en 1912, Max Von Laue descubrió que mediante Rayos X podíamos colocar los átomos allá donde queramos.
Clasificación.
Existen diversos métodos para determinar el tamaño de grano, como se ven en un microscopio. El método que se explica aquí es el que utiliza con frecuencia los fabricantes. El tamaño de grano se determina por medio de la cuenta de los granos en cada pulgada cuadrada bajo un aumento de 100X.
Clasificación por densidad e importancia industrial.
Voy a habar un poco sobre la importancia industrial de los metales, aún creyendo que casi no es necesario ya que si te fijas un poco en tu entorno algo de metal tienes alrededor. El meta se extrae de las rocas y mediante un proceso en el cual el material es depurado se obtiene un material que se llama metal puro. Este material no creo que le utilicemos ya que es muy caro, lo que utilizamos nosotros son aleaciones metálicas.
En la parte que a mi me toca, la parte de la automoción, puedo decir que el metal es muy importante ya que se encuentra en la mayor parte del vehículo. O también en elementos que yo utilizo para poder arreglar el vehículo. En conclusión el metal es muy importante en el sector industrial ya que nos rodea en todo momento.
La densidad es la cantidad de masa en un determinado volumen de una sustancia. Expongo una tabla con metales y sus densidades.
El acero.
El acero es una mezcla de hierro con una cantidad de carbono variable entre el 0,03 % y el 2,14 % en masa de su composición, dependiendo del grado. Si la aleación posee una concentración de carbono mayor al 2,14 % se producen fundiciones que, en oposición al acero, son mucho más frágiles y no es posible forjarlas sino que deben ser moldeadas.
La diferencia principal entre el hierro y el acero se halla en el porcentaje del carbono: el acero es hierro con un porcentaje de carbono de entre el 0,03 % y el 1,075 %, a partir de este porcentaje se consideran otras aleaciones con hierro.
Varillas de acero
Historia.
El término acero procede del latín "aciarius", y éste de la palabra "acies", que es como se denomina en esta lengua el filo de un arma blanca. "Aciarius" sería, por tanto, el metal adecuado, por su dureza y resistencia, para ponerlo en la parte cortante de las armas y las herramientas. Se desconoce la fecha exacta en que se descubrió la técnica para obtener hierro a partir de la fusión de minerales. Sin embargo, los primeros restos arqueológicos de utensilios de hierro datan del 3000 a. C. y fueron descubiertos en Egipto, aunque hay rastros de adornos anteriores. Algunos de los primeros aceros provienen del este de África, cerca de 1400 a. C. Durante la dinastía Han de China se produjo acero al derretir hierro forjado con hierro fundido, en torno al siglo I a. C. También adoptaron los métodos de producción para la creación de acero wootz, un proceso surgido en India y en Sri Lanka desde aproximadamente el año 300 a. C. y exportado a China hacia el siglo V.
En 1856, Henry Bessemer, desarrolló un método para producir acero en grandes cantidades, pero dado que sólo podía emplearse hierro que contuviese fósforo y azufre en pequeñas proporciones, fue dejado de lado. Al año siguiente, Carl Wilhelm Siemens creó otro, el procedimiento Martin-Siemens, en el que se producía acero a partir de la descarburación de la fundición de hierro dulce y óxido de hierro como producto del calentamiento con aceite, gas de coque, o una mezcla este último con gas de alto horno. Este método también quedó en desuso.
Aunque en 1878 Siemens también fue el primero en emplear electricidad para calentar los hornos de acero, el uso de hornos de arco eléctricos para la producción comercial comenzó en 1902 por Paul Héroult, quien fue uno de los inventores del método moderno para fundir aluminio. En este método se hace pasar dentro del horno un arco eléctrico entre chatarra de acero cuya composición se conoce y unos grandes electrodos de carbono situados en el techo del horno.
Actualmente, el proceso de fabricación del acero, se completa mediante la llamada metalurgia secundaria. En esta etapa, se otorgan al acero líquido las propiedades químicas, temperatura, contenido de gases, nivel de inclusiones e impurezas deseados. La unidad más común de metalurgia secundaria es el horno cuchara. El acero, aquí producido, está listo para ser posteriormente colado, en forma convencional o en colada continua.
Componentes del acero.
Los dos componentes principales del acero (hierro y carbono) se encuentran en abundancia en la naturaleza, lo que favorece su producción a gran escala. Esta variedad y disponibilidad lo hace apto para numerosos usos como la construcción de maquinaria, herramientas, edificios y obras públicas, contribuyendo al desarrollo tecnológico de las sociedades industrializadas. A pesar de su densidad (7850 kg/m³ de densidad en comparación a los 2700 kg/m³ del aluminio, por ejemplo) el acero es utilizado en todos los sectores de la industria, incluso en el aeronáutico, ya que las piezas con mayores solicitaciones (ya sea al Impacto o a la fatiga) solo pueden aguantar con un material dúctil y tenaz como es el acero, además de la ventaja de su relativo bajo costo.
Características mecánicas del acero.
Es difícil de establecer las propiedades físicas y mecánicas del acero ya que estas varían con los ajustes en su composición. Aun así, se pueden citar algunas características genéricas:
- Su densidad media es de 7850 kg/m³.
- En función de la temperatura el acero se puede contraer, dilatar o fundir.
- El punto de fusión del acero depende del tipo de aleación y los porcentajes de elementos aleantes. El de su componente principal, el hierro es de alrededor de 1510 °C en estado puro (sin alear), sin embargo el acero presenta frecuentemente temperaturas de fusión de alrededor de 1375 °C, y en general la temperatura necesaria para la fusión aumenta a medida que se aumenta el porcentaje de carbono y de otros aleantes. (excepto las aleaciones eutécticas que funden de golpe). Por otra parte el acero rápido funde a 1650 °C.
- Su punto de ebullición es de alrededor de 3000 °C.
- Es un material muy tenaz.
- Es dúctil. Con él se obtienen alambres.
- Es maleable. Se pueden obtener láminas delgadas como por ejemplo la hojalata, que es una lámina de acero, de entre 0,5 y 0,12 mm de espesor, recubierta, generalmente de forma electrolítica, por estaño.
- Permite una buena mecanización en máquinas herramientas antes de recibir un tratamiento térmico.
Color del acero según su temperatura.
Como sabemos, cuando al acero le calentamos va cambiando de color, para saber a que temperaturas cambia el color lo que voy a hacer es subir una foto donde viene los datos de la temperatura y el color que adquiere el acero a cierta temperatura.
El aluminio.
El aluminio es el tercer elemento más común encontrado en la corteza terrestre. Los compuestos de aluminio forman el 8 % de la corteza de la tierra y se encuentran presentes en la mayoría de las rocas, de la vegetación y de los animales. En estado natural se encuentra en muchos silicatos.
Como metal se extrae únicamente del mineral conocido con el nombre de bauxita, por transformación primero en alúmina mediante el proceso Bayer y a continuación en aluminio metálico mediante electrólisis. Este metal posee una combinación de propiedades que lo hacen muy útil en ingeniería de materiales, tales como su baja densidad (2700 kg/m³) y su alta resistencia a la corrosión. Mediante aleaciones adecuadas se puede aumentar sensiblemente su resistencia mecánica. Es buen conductor de la electricidad y del calor, se mecaniza con facilidad y es muy barato. Por todo ello es desde mediados del siglo XX el metal que más se utiliza después del acero.
Historia.
El aluminio se utilizaba en la antigüedad clásica en tintorería y medicina bajo la forma de una sal doble, conocida como alumbre y que se sigue usando hoy en día. En el siglo XIX, con el desarrollo de la física y la química, se identificó el elemento. Su nombre inicial, aluminum, fue propuesto por el británico Sir Humphrey Davy en el año 1809.
En el año 1825, el físico danés Hans Christian Ørsted, descubridor del electromagnetismo, logró aislar por electrólisis unas primeras muestras, bastante impuras. El aislamiento total fue conseguido dos años después por Friedrich Wöhler.
Características.
- El aluminio es un elemento muy abundante en la naturaleza, solo aventajado por el oxígeno. Se trata de un metal ligero, con una densidad de 2700 kg/m³, y con un bajo punto de fusión (660 °C). Su color es blanco y refleja bien la radiación electromagnética del espectro visible y el térmico. Es buen conductor eléctrico.
- Es un material blando y maleable. En estado puro tiene un límite de resistencia en tracción de 160-200 N/mm². Todo ello le hace adecuado para la fabricación de cables eléctricos y láminas delgadas, pero no como elemento estructural. Para mejorar estas propiedades se alea con otros metales, lo que permite realizar sobre él operaciones de fundición y forja, así como la extrusión del material. También de esta forma se utiliza como soldadura.
- La capa de valencia del aluminio está poblada por tres electrones, por lo que su estado normal de oxidación es III. Esto hace que reaccione con el oxígeno de la atmósfera formando con rapidez una fina capa gris mate de alúmina, que recubre el material, aislándolo de corrosiones. Esta capa puede disolverse con ácido cítrico. A pesar de ello es tan estable que se usa con frecuencia para extraer otros metales de sus óxidos.
Aplicaciones.
Papel de aluminio
Y hasta aquí puedo llegar, ya que este tema de los materiales metálicas es muy extenso y podría dar muchas más información pero creo que con esto valdrá. Puede que esta entrada haya sido bastante teórica pero no todas van a ser iguales. Un saludo.